Ha pasado ya un largo tiempo desde que publiqué la última entrada dedicada a las técnicas más habituales de los laboratorios del mundo, por lo que esta sección reclamaba su presencia en el blog. En esta nueva ocasión, la técnica a repasar es una de las técnicas cuantitativo – analíticas favoritas para quienes, como yo, nos gusta cuantificar los nutrientes, enzimas, minerales, compuestos o sustancias presentes en una muestra; esto es, la espectrofotometría. Esta técnica, combina conceptos de física, química, matemáticas y un poco de biología (sobre todo en lo referente al tipo de muestras objeto de su medida), resultando de gran utilidad para el trabajo del día a día en los laboratorios. Así que, si quieres saber un poco más sobre ella, no dudes en seguir leyendo.
El primer científico que sentó las bases de lo que sería la futura espectrofotometría, fue Isaac Newton quién, a través de experimentos con prismas, estableció los principios de la dispersión y refracción de la luz y definió «espectro» como todas aquellas partes constitutivas de la luz 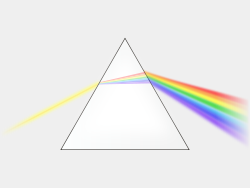 blanca (colores del arcoiris), obtenidas a partir del paso de dicha luz, por medio de un prisma. A partir de estos conocimientos, ya en el siglo XIX, empezaron a surgir los primeros experimentos que trataban de determinar cuantitativamente la cantidad de luz dispersada; uno de estos científicos, considerarado como uno de los «padres» de la espectrofotometría, fue Joseph von Fraunhofer. Este físico y óptico alemán, diseñó una rendija de difracción (conocida más tarde como monocromador), que utilizando las interferencias de las diferentes frentes de ondas, conseguía difractar la luz y, con ello, mejorar la resolución expectral y medir de manera casi exacta, las longitudes de onda de la luz visible. Usando su propia técnica, estudió el espectro solar y obtuvo los valores de las longitudes de onda correspondientes a las líneas de absorción del espectro solar, conocidas como líneas de Fraunhofer. En 1859, dos científicos alemanes, el físico Gustav Kirchhoff y el químico Robert Bunsen, utilizarían estas líneas de Fraunhofer, para sentar las bases de la espectroscopía como técnica analítica.
blanca (colores del arcoiris), obtenidas a partir del paso de dicha luz, por medio de un prisma. A partir de estos conocimientos, ya en el siglo XIX, empezaron a surgir los primeros experimentos que trataban de determinar cuantitativamente la cantidad de luz dispersada; uno de estos científicos, considerarado como uno de los «padres» de la espectrofotometría, fue Joseph von Fraunhofer. Este físico y óptico alemán, diseñó una rendija de difracción (conocida más tarde como monocromador), que utilizando las interferencias de las diferentes frentes de ondas, conseguía difractar la luz y, con ello, mejorar la resolución expectral y medir de manera casi exacta, las longitudes de onda de la luz visible. Usando su propia técnica, estudió el espectro solar y obtuvo los valores de las longitudes de onda correspondientes a las líneas de absorción del espectro solar, conocidas como líneas de Fraunhofer. En 1859, dos científicos alemanes, el físico Gustav Kirchhoff y el químico Robert Bunsen, utilizarían estas líneas de Fraunhofer, para sentar las bases de la espectroscopía como técnica analítica.
La espectroscopia, se define como la ciencia que se encarga de estudiar la interacción producida entre la materia y la energía radiada (transmitida y absorbida en unas longitudes de onda determinadas) ubicada dentro de ciertos rangos del espectro electromagnético. A partir de este fundamento, Kirchhoff y Bunsen, llegaron a la conclusión de que cada elemento y/o compuesto tiene un espectro específico, entendiendo por espectro a conjunto de longitudes de onda de las líneas de absorción y emisión de energía radiante, obtenidas al someter a ese elemento y/o compuesto a la acción de una radiación. Esto se explica, a través de la ley de la radiación térmica de Kirchhoff, que dice que: «la potencia o intensidad de la energía transmitida y la potencia o intensidad de la energía radiante absorbida por parte de la materia, ante una longitud de onda y un valor de temperatura determinado, serán siempre los mismos para esa misma materia«. Con todo ello, se puede, mediante el estudio del espectro de una fuente desconocida, determinar su composición química, siendo así la espectroscopía, una buena herramienta analítica no sólo para sondear el análisis espectro-químico o la estructura atómica o molecular de sus materiales, sino también para el análisis de la composición de los materiales.
La parte de la espectroscopía encargada de medir o cuantificar esa energía radiada absorbida por parte de la materia, es la espectrofotometría. Más que una ciencia, se trata de una técnica analítica que mide la intensidad de radiación que absorbe una muestra (conjunto de elementos y/o elemento puro), en función de la longitud de onda de la radiación incidente, permitiendo identificar las sustancias o elementos orgánicos e inorgánicos de la muestra y sobre todo, cuantificar la concentración de dichas sustancias o elementos. Dicha intensidad de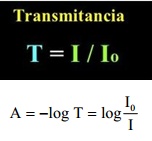 radiación, se mide por medio del cálculo de la absorbancia (A) y la transmitancia (T). La transmitancia (T) se calcula a través del cociente entre la intensidad o potencia de la radiación trasmitida (I) y la intensidad o potencia de la radiación incidente (Io). Por su parte, la absorbancia (A) se calcula a partir del logaritmo en base 10 del cociente entre la intensidad o potencia de la radiación incidente y la intensidad o potencia de la radiación transmitida.
radiación, se mide por medio del cálculo de la absorbancia (A) y la transmitancia (T). La transmitancia (T) se calcula a través del cociente entre la intensidad o potencia de la radiación trasmitida (I) y la intensidad o potencia de la radiación incidente (Io). Por su parte, la absorbancia (A) se calcula a partir del logaritmo en base 10 del cociente entre la intensidad o potencia de la radiación incidente y la intensidad o potencia de la radiación transmitida.
Para poder medir dichos parámetros, es necesario considerar antes que, por un lado, la radiación a la que se somete a las sustancias y/o elementos de la muestra, actúa como fotón o cuanto (paquetes de energía) y por otro lado, que ciertas moléculas presentes en las sustancias y/o elementos a cuantificar, contienen grupos cromóforos (grupos funcionales: dobles y triples enlaces de carbono, grupos carbonilo o sistemas aromáticos), que en presencia de esos fotones, permiten la absorción de parte de la energía del fotón (éste, al incidir sobre las moléculas, provoca una excitación de los niveles electrónicos de la misma, aumentando su energía) que se corresponde a una longitud de onda determinada de la radiación incidente y por consiguiente, son responsables  de la coloración de la sustancia y/o elemento (color complementario al correspondiente a la longitud de onda de la radiación que se absorbe). La energía restante del fotón, no se absorberá y será la que finalmente constituya la radiación transmitida. La acción de estos grupos cromóforos, además, puede verse intensificada por la presencia de auxocromos (grupo amino, metilo, hidroxi), que añadiéndose como reactivos a la muestra/solución, modifican la intensidad de la radiación transmitida (efecto hipercrómico/hipsocrómico) y la intensidad de la radiación absorbida a diferentes longitudes de onda (efecto batocrómico/hipsocrómico).
de la coloración de la sustancia y/o elemento (color complementario al correspondiente a la longitud de onda de la radiación que se absorbe). La energía restante del fotón, no se absorberá y será la que finalmente constituya la radiación transmitida. La acción de estos grupos cromóforos, además, puede verse intensificada por la presencia de auxocromos (grupo amino, metilo, hidroxi), que añadiéndose como reactivos a la muestra/solución, modifican la intensidad de la radiación transmitida (efecto hipercrómico/hipsocrómico) y la intensidad de la radiación absorbida a diferentes longitudes de onda (efecto batocrómico/hipsocrómico).
Para aquellas sustancias/elementos que absorben radiación dentro del espectro de la radiación visible y ultravioleta, existe una ley llamada ley de Beer- Lambert-Bouguer, descubierta por primera vez por Pierre Bouguer cuando definía la cantidad de luz que se pierde al atravesar una extensión de materia, y posteriormente por los matemáticos August Beer y Johann Heinrich Lambert, de manera independiente. Esta ley permite conocer cuál es la relación entre la transmitancia y la absorbancia, en una solución de concentración delimitada (a mayor concentración, se modifican las propiedades de absorción de la muestra), 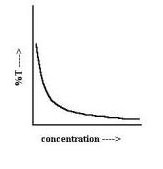 sometida a la acción de una radiación monocromática (de una longitud de onda determinada, seleccionada para generar un pico de absorción máximo). Según esta ley, en esas condiciones: «la intensidad de la luz transmitida, disminuye exponencialmente a medida que la concentración molar de las sustancias absorbentes, aumentan». Respecto a la absorbancia, observaron que ésta depende en un grado de proporción directa de la concentración molar y el valor de absortividad (coeficiente de extinción, (ε) o grado de absorción de la radiación por parte de una sustancia, en función de una longitud de onda dada) y de la distancia recorrida por la radiación en la muestra. Para la identificación de las sustancias/elementos esta ley Beer-Lambert, presenta algunas desviaciones.
sometida a la acción de una radiación monocromática (de una longitud de onda determinada, seleccionada para generar un pico de absorción máximo). Según esta ley, en esas condiciones: «la intensidad de la luz transmitida, disminuye exponencialmente a medida que la concentración molar de las sustancias absorbentes, aumentan». Respecto a la absorbancia, observaron que ésta depende en un grado de proporción directa de la concentración molar y el valor de absortividad (coeficiente de extinción, (ε) o grado de absorción de la radiación por parte de una sustancia, en función de una longitud de onda dada) y de la distancia recorrida por la radiación en la muestra. Para la identificación de las sustancias/elementos esta ley Beer-Lambert, presenta algunas desviaciones.
Tomando alícuotas de concentración progresiva de una muestra patrón de concentración conocida y midiendo su absorbancia a diferentes longitudes de onda, se obtiene la recta de calibración que permite, posteriormente, extrapolar la concentración de las sustancias/elementos de la muestra o solución, a partir de su valor de absorbancia. 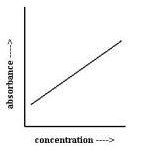
Todo lo hasta ahora descrito, se refiere principalmente a la espectrofotometría de absorción molecular en la región del espectro visible – ultravioleta. Otros tipos de espectrofotometría de aplicación analítica son, la espectrofotometría de absorción y emisión atómica (utiliza una llama como fuente de radiación, generando la atomización de las muestras para medir la absorbancia y emisión de energía por parte de los atómos ante la acción de la energía radiante) o la espectrofotometría de infrarrojo cercano, medio y lejano (se miden las variaciones vibracionales de los enlaces químicos de las moléculas).
Hasta aquí la parte teórica, pero para poder llevar a cabo la medición de una manera práctica, fue necesaria la fabricación de un instrumento que realizara dichas medidas. Este no fue otro que el espectrofotómetro, que consta de: una fuente de radiación (lámpara de tungsteno para el espectro visible, lámpara de deuterio para el espectro ultravioleta), un sistema monocromador (prisma + rendija de difracción de entrada y de salida), una cubeta que contiene la muestra (de forma rectangular de cuarzo, vidrio o plástico, transparentes y sin huellas o rayaduras), un fotodetector y finalmente, un mecanismo para el registro de los datos. En este caso, se trata de un espectrofotómetro de haz simple, puesto que contienen una única cubeta para la muestra y es necesario realizar una calibración a absorbancia cero (sustancia que transmite toda la radiación incidente) para luego medir la absorbancia de la muestra. En el caso de los espectrofotómetros de doble haz, contienen dos cubetas que permiten realizar el calibrado del blanco directamente en una de ellas, mientras que en la otra se miden las muestras a estudiar.
A raíz de las investigaciones realizadas sobre la vitamina A y la necesidad por parte del gobierno norteamericano, de cuantificar el contenido de dicha vitamina en las raciones destinadas a los soldados combatientes de la II Guerra Mundial, se diseñó y comercializó el primer espectrofotómetro de detección fotoeléctrica, pretendiendo mejorar las características técnicas de los espectrofotómetros de detección fotográfica (poco eficientes), hasta ese momento, los más habituales en las prácticas analíticas. El encargado de tal hazaña, fue Arnold J. Beckman en 1941 y rápidamente se convirtió en uno de los instrumentos analíticos, más empleados en los laboratorios de la época de post-guerra, por su gran rapidez y exactitud en la obtención de resultados (hasta el 99,99% de precisión).
A partir de este primer modelo, se crearon otros modificando aspectos tales como, el tipo de monocromador empleado (se pasó de un prisma de cuarzo a un prisma de cristal que ampliaba la resolución espectral al rango de ultravioleta) del tipo de fuente de radiación o de un nuevo sistema de fotodetección, que permitía reducir el tiempo de escaneado del espectro de longitudes de onda. A medida que transcurre el tiempo, el coste de producción del espectrofotómetro se reduce y en 1954, se fabrica el primer espectrofotómetro de doble haz, precursor del Spectronic de 1980,dónde se incluía además de la doble haz, un microprocesador de datos. Un año antes, en el 1979 se fabricó el primer espectrofotómetro de diodos, permitiendo reducir aún más el tiempo de escaneado  del espectro de longitudes de onda de las regiones de radiación visible, ultravioleta e infrarrojo. El avance del espectrofotómetro continuó con nuevas mejoras en el sistema de registro (incorporación de un sistema de almacenamiento informático, reprocesamientos y o visualización de los datos en pantalla) o en la fuente de radiación (utilización de lámparas de xenón, más eficaces y con una mayor vida útil). Cómo reconocimiento a toda estas innovaciones introducidas en el campo del análisis químico, en 1989 se le reconoció la Medalla Nacional de Ciencia del gobierno norteamericano, al señor Arnold J. Beckman, por su liderazgo en el desarrollo de esta nueva técnica analítica.
del espectro de longitudes de onda de las regiones de radiación visible, ultravioleta e infrarrojo. El avance del espectrofotómetro continuó con nuevas mejoras en el sistema de registro (incorporación de un sistema de almacenamiento informático, reprocesamientos y o visualización de los datos en pantalla) o en la fuente de radiación (utilización de lámparas de xenón, más eficaces y con una mayor vida útil). Cómo reconocimiento a toda estas innovaciones introducidas en el campo del análisis químico, en 1989 se le reconoció la Medalla Nacional de Ciencia del gobierno norteamericano, al señor Arnold J. Beckman, por su liderazgo en el desarrollo de esta nueva técnica analítica.
Hasta aquí el repaso histórico – teórico sobre la espectroscopia y la espectrofotometría,una de las técnicas analíticas que más influencia, a mi modo de ver, tuvieron y tienen sobre el avance de las ciencias y técnicas analíticas. Espero que os haya gustado, pues como dijo en su momento Bruce Merrifield, ganador del premio Nobel de Química en 1984, el espectrofotómetro (y la espectrofotometría como técnica) era «probablemente el instrumento más importante que se ha desarrollado hacia el avance de la biociencia«.
¡Nos «leemos» en la próxima entrada!
TatianaDC
NOTA: Esta entrada participa en la LI Edición del Carnaval de Química, alojada en el blog Scientia.
Fuentes
http://web.mit.edu/spectroscopy/history/history-classical.html http://www.researchgate.net/post/What_is_the_difference_between_spectrophotometry_spectroscopy_and_spectrometry http://cellbiologyolm.stevegallik.org/node/8 http://cellbiologyolm.stevegallik.org/node/6 http://www.chemheritage.org/discover/collections/collection-items/scientific-instruments/beckman-du-uv-vis-spectrophotometer-and-power-supply.aspx http://www.labmanager.com/lab-product/2011/07/evolution-of-uv-vis-spectrophotometers http://datateca.unad.edu.co/contenidos/401539/exe-2%20de%20agosto/index.html http://pubs.acs.org/doi/abs/10.1021/ac50011a710 http://www.ehow.com/about_6595173_history-spectrophotometry.html http://labsynergy.wordpress.com/2011/03/08/history-of-spectrophotometer/ http://www.slideshare.net/arturo.caballero/espectrofotometra-29439943?qid=82448fec-b46b-4dc9-a3cf-468208fda0c6&v=default&b=&from_search=5 http://en.wikipedia.org/wiki/Spectrophotometry http://es.wikipedia.org/wiki/Joseph_von_Fraunhofer http://en.wikipedia.org/wiki/History_of_spectroscopy







Pingback: Resumen de la LI Edición del Carnaval de la Química | SCIENTIA